Cytokininy fragment: Regulatory wzrostu i rozwoju roślin
Fragmenty książki:
Regulatory wzrostu i rozwoju roślin tom:1 Właściwości i działanie.
PWN 1997
2.3.Cytokininy
Bożena Borkowska
Instytut Sadownictwa i Kwiaciarstwa, Skierniewice
2.3.1. Odkrycie cytokinin
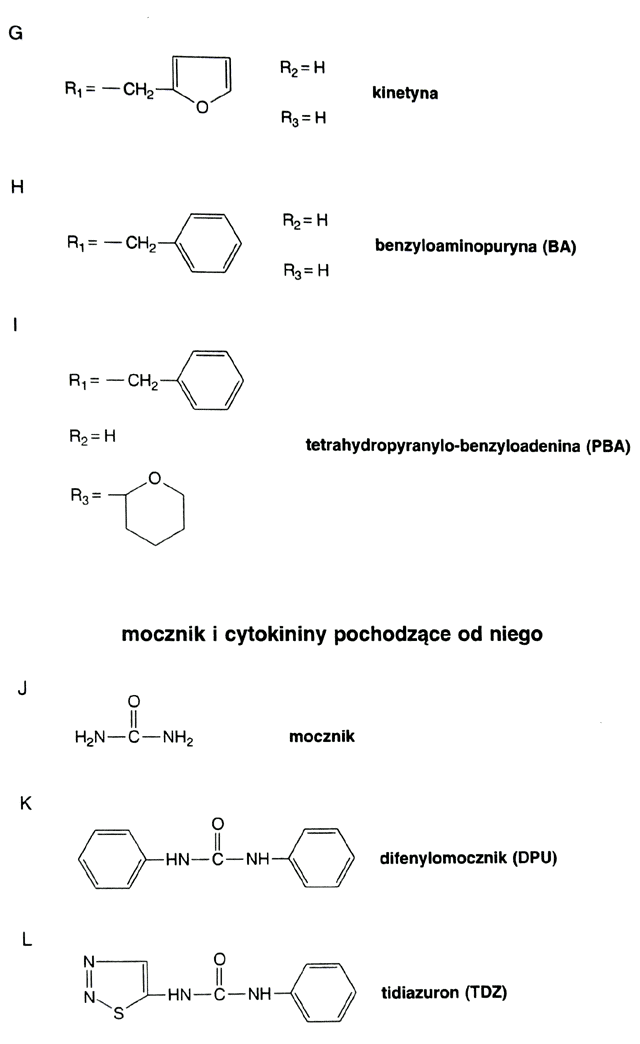
Już w 1892 roku Wiesner i nieco później Haberland (1913) postulowali istnienie hormonów stymulujących podziały komórkowe [43]. Dopiero jednak w 1955 roku Miller i inni [38] wyizolowali z materiału zwierzęcego związek silnie stymulujący podziały komórkowe roślin. Związek ten został zidentyfikowany i nazwany kinetyną (ryc. 2.3.1 G).
Odkrycie w materiale roślinnym związków o właściwościach podobnych do kinetyny było związane z rozwojem techniki kultur tkankowych. W latach 50. zauważono, że po dodaniu do pożywki w kulturach in vitro mleka kokosowego, komórki hodowanej tkanki zaczynają się intensywnie dzielić. Efekt ten przypisano występowaniu w mleku kokosowym substancji o właściwościach kinetyny. Wkrótce potem Miller [37] i Letham [32] wyodrębnili z niedojrzałych ziaren kukurydzy związek, który silnie stymulował podziały komórkowe. Ustalono jego strukturę i nazwano go zeatyną, od łacińskiej nazwy kukurydzy - Zea mays (ryc. 2.3.1 B). W następnych latach wyizolowano wiele innych związków o właściwościach podobnych do kinetyny i zeatyny. Całą grupę tych związków nazwano pierwotnie kininami. Ponieważ jednak nazwą tą określano już niektóre białka zwierzęce, wprowadzono nowy termin cytokininy. Nazwa ta charakteryzuje działanie tych związków - stymulację cytokinezy.
Prace przeglądowe na temat tej grupy regulatorów roślinnych opublikowali: Leshem [31], Borkowska [8] oraz Moore [43] i Matsubara [34], a ich nomenklaturę omawiają Crouch i inni [14a].
2.3.2. Aktywność biologiczna
Charakterystycznymi cechami działania cytokinin jest stymulacja podziałów komórkowych oraz opóźnianie procesu starzenia. Duży wpływ wywierają cytokininy na procesy biochemiczne, takie jak: stymulacja biosyntezy kwasów nukleinowych, białek i wielu enzymów, jak również obniżanie aktywności rybonukleaz i proteaz.
Cytokininy oddziałują również na wiele istotnych procesów fizjologicznych, np. stymulują kiełkowanie nasion wymagających światła oraz skracają spoczynek pąków. Są one również bardzo aktywnym czynnikiem w regulacji morfogenezy roślin, głównie przez znoszenie dominacji wierzchołkowej w pędach, co powoduje wybijanie pąków bocznych. Niebagatelne znaczenie cytokinin w praktyce ogrodniczej ma indukcja pąków przybyszowych oraz hamowanie tworzenia i wzrostu korzeni. U niektórych gatunków roślin mogą one brać udział w procesach związanych z inicjacją pąków kwiatowych i ze zrzucaniem zawiązków owocowych [7, 25, 35, 33].
Zjawisko indukcji pąków oraz stymulacji podziałów komórkowych jest szeroko wykorzystywane w mikrorozmnażaniu oraz w regeneracji roślin ze stransformowanej tkanki. Można kierować rozwojem hodowanego materiału roślinnego przez dodanie do pożywki cytokininy, co reguluje liczbę podziałów komórkowych, tworzenie pąków, wyrastanie pędów lub hamowanie rozwoju korzeni. Zmiany morfologiczne hodowanej tkanki czy organu są najczęściej rezultatem zwiększenia aktywności mitotycznej [10]. Mogą być również związane z różnicowaniem systemu przewodzącego, co w pośredni sposób (przez aktywację transportu) wpływa na rozwój rośliny [2].
Wpływ cytokinin na morfogenezę jest również wykorzystywany w praktyce ogrodniczej przez traktowanie roślin preparatami zawierającymi cytokininy. W sadownictwie stosowany jest np. preparat zawierający benzyloaminopurynę - Promalin, który zwiększa liczbę bocznych rozgałęzień, a także może zmienić ich kąt położenia w stosunku do pędu głównego [28]. Również związki o właściwościach cytokinin z grupy pochodnych mocznikowych, np. CPPU, mogą powodować zmiany w kształcie owoców i drzew jabłoni [60]. Zdolność cytokinin do opóźniania starzenia próbuje się wykorzystać do podwyższenia plonu pszenicy. Stwierdzono, że cytokinina mocznikowa 4-PU-30, czyli N-(chloro-4-pirydylo)-N-fenylomocznik przedłuża aktywność fotosyntetyczną liścia flagowego pszenicy, co znajduje odbicie w wyższym plonie [1].
Przez długi czas badania roli cytokinin w morfogenezie opierały się na traktowaniu roślin lub tkanek związkami z grupy cytokinin, jak również na określaniu poziomu endogennych cytokinin, w zależności od wpływu czynników egzogennych lub wewnętrznych. Dopiero w ostatnich latach podjęto badania mające na celu wyjaśnienie molekularnych mechanizmów, warunkujących działanie cytokinin w morfogenezie roślin. Technika biologii molekularnej jest stosowana z coraz większymi sukcesami do badania roli hormonów (w tym i cytokinin) w rozwoju roślin. Zasadniczym zwrotem w badaniach nad cytokininami było ustalenie sekwencji i sklonowanie genu itp9 kodującego enzym transferazę izopentenylową [3]. Następnym etapem po sklonowaniu i scharakteryzowaniu genu itp z Agrobacterium tumefaciens było wprowadzenie go do genomu roślinnego.
W stransformowanych roślinach tytoniu stwierdzono kilkukrotne podwyższenie poziomu endogennych cytokinin, stymulację podziałów komórkowych oraz efekty morfologiczne, takie jak wzrost pędów bocznych, z których wyrastały pędy następnych rzędów. Stwierdzono także przedłużenie okresu wegetatywnego wzrostu, zwiększenie stosunku pędów do korzeni oraz opóźnianie starzenia [22, 36, 64].
Olbrzymie znaczenie w określaniu współdziałania cytokinin z auksynami w morfogenezie roślin miało odkrycie u A. tumefaciens dwóch genów tms i tmr kodujących biosyntezę odpowiednio: auksyn i cytokinin [18], (p. także rozdz. 2.3.6). Watillon i inni [67], w badaniach nad udziałem cytokinin w ekspresji genów biorących udział w morfogenezie, wykorzystali zjawisko tworzenia w kulturach in vitro jabłoni licznych pędów w obecności cytokininy (BA) oraz zupełny brak procesu proliferacji przy braku cytokininy w pożywce. W pędach kultur jabłoni wziętych z tego układu doświadczalnego znaleziono i scharakteryzowano 2 geny, których ekspresja była związana z obecnością lub brakiem cytokininy w pożywce.
Sygnał molekularny (pochodzący z genów) musi być odebrany i odczytany przez odpowiednie receptory i przekazany dalej "do realizacji". Do tej pory nie udało się zidentyfikować receptorów cytokinin, chociaż określono kilka białek, które mogą spełniać rolę receptorów dla niektórych cytokinin. Badania na ten temat są intensywnie prowadzone [3a], (rozdz. 3.1).
2.3.3. Budowa chemiczna
Naturalne cytokininy stanowią jednorodną grupę związków - są pochodnymi adeniny. Skoog i inni [54] stwierdzili, że aktywność biologiczną mają związki, w których boczny łańcuch jest przyłączany do adeniny w pozycji (N6), (ryc. 2.3.1 A). Aktywność ta zmienia się w zależności od długości bocznego łańcucha, stopnia jego wysycenia i rodzaju podstawników. Dodatkowe połączenia pierścienia purynowego w pozycjach innych niż N6 zmniejszają aktywność biologiczną związku.
Istnieje także grupa związków niepurynowych, które mają właściwości cytokinin. Są to pochodne mocznika. Nie ma całkowitej zgodności co do tego, czy związki te można nazywać cytokininami. Obecnie jednak mówi się najczęściej o dwóch grupach cytokinin "pochodnych purynowych" i "pochodnych mocznikowych". Istnieją trzy hipotezy dotyczące działania cytokinin mocznikowych:
a) Bruce i inni [11] oraz Kurosaki i inni [30] uważają, że obie grupy cytokinin mają wspólne aktywne miejsce. Według tych autorów u cytokinin mocznikowych jest to wiązanie -NH-CO-NH, a u cytokinin purynowych -N-C-N (fragment pierścienia adeninowego - pozycja 7, 8, 9);
b) cytokininy mocznikowe działają pośrednią drogą, pełniąc rolę donora bocznego łańcucha lub pobudzając produkcję cytokinin purynowych. Hipoteza ta jest poparta badaniami Thomasa i Kattermana [62]. W doświadczeniach tych autorów stężenie endogennych cytokinin purynowych w kulturach kalusa soi wzrastało po dodaniu tidiazuronu;
c) cytokininy mocznikowe wpływają na biosyntezę, metabolizm i transport cytokinin purynowych, regulując w ten sposób ich stężenie [27]. Hipoteza ta ma najsłabsze poparcie eksperymentalne.
W badaniach nad mechanizmem działania cytokinin mocznikowych i relacją między obydwoma grupami cytokinin wykorzystano związki o charakterze antycytokinin (antagonistów cytokinin). Działanie tych związków jest widoczne wyłącznie przy równoczesnym podaniu z cytokininami i polega na obniżaniu lub całkowitym przeciwdziałaniu ich aktywności, np. nie obserwuje się opóźniania starzenia liści lub stymulacji wzrostu kalusa tytoniu w obecności BA lub forchlorfenuronu przy równoczesnym dodaniu antycytokininy. Do antycytokinin należy 4-(cyklobutyloami- no)-2-metylopirolo-(2,3-d) pirimidyna (CP), [30].
Fakt, że cytokininy z obydwu grup (adeninowe i mocznikowe) są hamowane przez tę samą antycytokininę potwierdzałby pierwszą z cytowanych hipotez mówiącą o tym samym aktywnym miejscu działania. Innym potwierdzeniem dla tej hipotezy było stwierdzenie, że zarówno tidiazuron (TDZ) i forchlorfenuron, jak i BA, działały w ten sam sposób, przyśpieszając formowanie polysomów i stymulując aktywność polimerazy RN A w liścieniach dyni [29].
W grupie cytokinin mocznikowych pierwszą odkrytą aktywną substancją był difenylomocznik (ryc. 2.3.1 K). Później przetestowano ponad 500 pochodnych difenylomocznika określając ich aktywność biologiczną [11]. Obecnie znanych i stosowanych jest kilka cytokinin mocznikowych. Szczególne znaczenie ma tidiazuron: N-(l,2,3-tiodiazolo-5-yl) N-fenylomocznik (ryc. 2.3.1 L), który wykazuje bardzo silną aktywność cytokininową i jest stosowany w kulturach in vitro dla tych roślin, które słabo reagują na benzyloaminopurynę (BA), [9, 24, 62].
Ostatnio wprowadza się do badań związki o aktywności cytokininowej należące do rodziny nitroguanidyn. Przedstawicielem tej grupy związków jest AC-243,654, czyli l-m-metoksybenzylo-3-nitroguanidyna. Związek ten zmienia cechy morfologiczne wielu roślin i zwiększa plon [51].
2.3.4. Cytokininy endogenne oraz syntetyczne
Cytokininy endogenne. Pierwszą wyizolowaną i zidentyfikowaną cytokininą naturalną była zeatyna [32, 37]. Zeatyna występuje jako wolna zasada, a także w połączeniu z rybozą (rybozyd) i resztą kwasu fosforowego (rybozyd), (ryc. 2.3.1 A, E, F). Może występować w połączeniu z glukozą (glikozyd) i innymi cukrami, np. ksylozą [41]. Zeatyna łączy się także z alaniną przyłączaną w pozycji 9, tworząc związek nieaktywny biologicznie. Na ogół najaktywniejszą formą zeatyny jest wolna zasada, chociaż są doniesienia o wyższej aktywności rybozydu zeatyny [15]. Aktywność wolnej zasady zależy od konfiguracji grupy hydroksylowej w bocznym łańcuchu. Grupa ta w zeatynie izolowanej z roślin występuje w pozycji trans (wyższa aktywność) (ryc. 2.3.1 B), a w zeatynie wyodrębnionej z tRNA występuje w pozycji cis (niższa aktywność). Grupa -OH w łańcuchu bocznym trans-zeatyny może przyłączać resztę kwasu fosforowego, tworząc allilowy fosforan zeatyny (ZAP). Nie jest jeszcze całkiem jasne jaką rolę ma spełniać fosforylacja zeatyny, otrzymane wyniki pozwalają jednak postawić hipotezę, że tworzenie ZAP może być związane z pobieraniem i transportem cytokinin przez membrany [65]. Naturalnie występującą pochodną zeatyny jest dihydrozeatyna - rycina 2.3.1 C. Związek ten nie ma podwójnego wiązania w bocznym łańcuchu i dlatego aktywność jego jest bardzo niska.
Inną naturalną cytokininą jest N6 (dimetyloalliloamino)-puryna, inaczej N6-delta2 -izopentenylo)adenina (2iP), (ryc. 2.3.1 D). Związek ten występuje w formie wolnej i związanej z tRNA. Może występować jako rybozyd: 9-betha -D-rybofuranozylo-N 6-(deltha2- -izopentenylo) adenina, czyli IPA lub jako rybotyd.
W topoli zidentyfikowano cytokininy - pochodne benzyloaminopuryny, w których pierścieniu benzenowym występuje w położeniu orto lub meta grupa hydroksylowa [56]. Praca ta potwierdza wcześniejsze dane, że pochodne BA występują naturalnie w roślinach. Tę grupę cytokinin nazwano "topoliny". A/eta-topolinę proponuje się stosować w kulturach tkankowych, gdyż mało hamuje ukorzenianie [67a]. W roślinach występuje wiele innych pochodnych adeniny, o różnej aktywności cytokininowej. Mogą one powstawać w wyniku przekształceń zeatyny [21]. Wśród kilku związków pochodnych mocznika, wykazujących aktywność cy- tokininową, tylko jeden: difenylomocznik, (ryc. 2.3.1 K), jest pochodzenia naturalnego [43].
Cytokininy syntetyczne. Spośród cytokinin syntetycznych, wysoką aktywność biologiczną wykazują kinetyna i benzyloaminopuryna. W mniejszym stopniu, ale również aktywna jest tetrahydropyranylo-benzyloadenina (PBA), (ryc. 2.3.1 I). Kinetyna jest pochodną adeniny, do której w pozycji 6 dołączony jest pierścień furanowy, (ryc. 2.3.1 G). Kinetynę wyizolowano wprawdzie z tkanki zwierzęcej, ale została uznana za artefakt i nie jest zaliczana do związków naturalnych. Benzyloadenina (skrót: BA lub BAP) jest pochodną adeniny, do której w pozycji 6 jest przyłączony pierścień benzenowy - rycina 2.3.1 H. BA jest najszerzej stosowaną cytokininą i wykazuje wysoką aktywność w stosunku do wielu roślin. Zarówno BA, jak i kinetyna są syntetyzowane w formie wolnej oraz jako rybozydy i rybotydy.
Oprócz wymienionych trzech cytokinin zsyntetyzowano ponad 70 pochodnych purynowych [54]. Ponieważ związki te mają tylko niewielką aktywność biologiczną lub są całkowicie nieaktywne rzadko znajdują zastosowanie praktyczne.
Spośród pochodnych mocznika, wspomniany już tidiazuron (TDZ) - rycina 2.3.1 L wykazuje wysoką aktywność cytokininową i znalazł zastosowanie w kulturach in vitro. Tidiazuron jest składnikiem preparatu o nazwie Dropp-50, który stosuje się do defoliacji. Również pochodną mocznikową jest związek N-(2-chloro-4-pirydylo)-N-fenylomocznik, występujący pod symbolem CPPU lub 4-PU-30 oraz pod nazwą forchlorfenuron. Próbuje się go stosować na jabłonie w celu zmiany wyglądu i składu chemicznego owoców [60], a także na zboża w celu opóźnienia starzenia się liści i tym samym podniesienia plonu [1].
2.3.5. Cytokininy występujące w tRNA i związane z białkami
Zachau i inni [68] pierwsi stwierdzili, że w tRNA specyficznym dla seryny w bezpośrednim sąsiedztwie antykodonu znajduje się zasada, która została zidentyfikowana jako 2iP. Później uściślono, że prawie zawsze jest to rybozyd 2iP. Stwierdzono również występowanie w tRNA rybozydu zeatyny oraz jej pochodnych tiometylowych i czasem innych związków zaliczanych do cytokinin. Związek 2iP występuje głównie w tRNA specyficznym dla seryny, ale spotyka się go również w tRNA charakterystycznych dla izoleucyny, tyrozyny i cysteiny. Generalnie, cytokininy występują w strukturze tych tRNA, w których sekwencja trzech zasad antykodonu zaczyna się od uracylu (U), [43].
Przez wiele lat sądzono, że cytokininy występują w kwasach nukleinowych wyłącznie w tRNA. Taller i inni [58] znaleźli rybozydy o aktywności cytokininowej (m.in. rybozyd zeatyny i 2iP), również w rRNA dwóch gatunków roślin. W doświadczeniach z radioaktywną BA i kinetyną stwierdzono, że one również mogą być przyłączone do tRNA i rRNA [16], (p. także rozdz. 3.1).
Cytokininy mogą występować w połączeniach z białkami [53]. Stwierdzono, że w zarodkach pszenicy występują takie połączenia przynajmniej z trzema białkami. Zostały one dokładnie scharakteryzowane [17]. W nowszych badaniach ustalono, że kompleks cytokinina-białko znajduje się na powierzchni membran chloroplastów i że połączenie to może odgrywać istotną rolę w intensyfikacji procesu fosforylacji zachodzącej w chloroplastach [43]. Białka łączące się z cytokininami mogą również spełniać rolę receptora - powstaje wtedy połączenie cytokinina-białko receptorowe (p. rozdz.3.1).
2.3.6. Biosynteza cytokinin
Uważa się, że głównym miejscem biosyntezy cytokinin są wierzchołki korzeni. Nie można jednak wykluczyć ich biosyntezy w innych tkankach merystematycznych, takich jak kambium, rozwijające się pąki, owoce czy kiełkujące nasiona. Uważa się, że nawet pędy i liście mogą być miejscem syntezy cytokinin [13]. Tamas i inni [59] podają, że synteza zeatyny odbywa się głównie w podstawowej części pędów i zmniejsza się w kierunku wierzchołka. Postuluje się, że istnieją dwie drogi prowadzące do powstania wolnych cytokinin:
a) uwalnianie cząsteczki z tRNA;
b) tworzenie cytokinin de novo.
Pierwsza z tych dróg, chociaż logicznie uzasadniona, nie ma wystarczającego poparcia eksperymentalnego. Jest natomiast wiele danych określających przebieg syntezy de novo i wskazujących na adeninę i na kwas mewalonowy jako prekursory odpowiednio: części purynowej i łańcucha bocznego cytokininy [42].
Niewątpliwym sukcesem w badaniach nad biosyntezą cytokinin było sklonowanie oraz scharakteryzowanie genu itp z A. tumefaciens, który jest odpowiedzialny za przyłączanie dimetyloallilopirofosforanu (DMAPP) do adenozynomonofosforanu (AMP) w pozycji N6 przez enzym ITP (transferaza izopentenylowa). Powstaje wtedy rybotyd cytokininy N6-zl2-izopentenylo-AMP (rybotyd 2iP). Związek ten może ulegać wielu przemianom, tworząc wiele cytokinin w formie iybotydów, rybozydów i wolnych zasad (włączając zeatynę i dihydrozeatynę), [3a]. Następnym osiągnięciem przybliżającym poznanie mechanizmu biosyntezy i działania cytokinin było ustalenie sekwencji i sklonowanie dwóch genów tmr i tms w plazmidowym DNA (T-DNA) Agrobacterium tumefaciens [55, 59]. Inaktywacja w T-DNA miejsca zawierającego 1 gen tmr lub tms powodowała rozwój hodowanej tkanki w kierunku tworzenia korzeni lub pędów. Obserwacja ta dała podstawę do przypuszczenia, że gen tmr jest odpowiedzialny za syntezę cytokinin, a gen tms za syntezę auksyn. Są to główne geny odpowiedzialne za współdziałanie tych dwóch regulatorów [3, 35], (p. także rozdz. 2.3.2).
2.3.7. Metabolizm cytokinin i mechanizm ich działania
Zarówno cytokininy endogenne, jak i egzogenne, które znalazły się w tkance ulegają intensywnym przemianom, prowadzącym do powstania form nieaktywnych biologicznie (są to tzw. formy zapasowe i transportowe) i do zwiększenia puli związków o znaczeniu regulacyjnym [3a, 5, 6, 14, 47]. Przemianom ulega zarówno część purynowa cząsteczki, jak i jej boczny łańcuch. Przemiany nie naruszające struktury cząsteczki cytokininy polegają na defosforylacji i odłączeniu rybozy, prowadząc do powstawania rybozydów i następnie wolnych zasad. Jedną z dróg przemian cytokinin jest redukcja bocznego łańcucha i tworzenie pochodnych dihydrozeatyny. Następnie może zajść glikolizowanie w pozycji 7 i 9. W przemianach cytokinin występuje również hydroksylacja bocznego łańcucha, prowadząc do powstawania pochodnych trans-zeatyny [3a, 40, 46, 57].
Prócz tego w tkance roślinnej istnieje metabolizm "degradacyjny", prowadzący do nieodwracalnego rozpadu cząsteczki [23]. Ta droga przemian związana jest z występowaniem i aktywnością enzymu oksydazy cytokininowej, jak również kilku innych enzymów: reduktazy zeatyny, cis-trans-izomerazy zeatyny, transferazy o-glukozylowej i o-ksylozylowej [3a, 50]. Występowanie oksydazy cytokininowej w różnych tkankach roślinnych potwierdziło wielu autorów [19, 26]. Enzym ten powoduje odłączenie bocznego łańcucha od adeniny. Z kolei adenina może podlegać dalszemu utlenianiu aż do mocznika i C02 [66]. Cytokininy z nasyconym łańcuchem izopentenylowym (np. dihydrozeatyna) i cytokininy syntetyczne (np. BA i kinetyna) nie podlegają działaniu oksydazy [12].
Duży postęp w badaniach nad metabolizmem cytokinin syntetycznych uzyskano dzięki rozwojowi kultur in vitro. Fakt, że do prawidłowego rozwoju kultur in vitro niezbędna jest stała obecność cytokinin, świadczyłby o ich intensywnym metabolizmie. Zostało to potwierdzone w licznych doświadczeniach, w których wykazano między innymi, że radioaktywna BA jest pobierana z pożywki w sposób ciągły, a jej stężenie w pędach jest znacznie niższe niż wynikałoby to z ilości pobranego związku [4, 5, 49]. Biondi i inni [4] sugerują, że główne pośrednie metabolity BA to: adenina i następnie mocznik, a końcowym produktem jego rozkładu jest C02 i inne związki lotne. Badając metabolizm 14C-tidiazuronu, stwierdzono glikolizowanie pierścienia fenylowego [39]. Sposób działania regulatorów wzrostu, w tym i cytokinin, jest ciągle bardzo słabo wyjaśniony (patrz rozdz. 3.1).
2.3.8. Transport cytokinin
Przekonanie, że głównym miejscem syntezy cytokinin są korzenie uzasadnia dosyć powszechną opinię o ich przemieszczaniu w ksylemie, w kierunku wierzchołkowym [63, 69]. Fakt znajdowania cytokinin w wydzielinie floemowej [61] ugruntowuje jednak hipotezę transportu cytokinin w obu kierunkach [43, 48]. Z drugiej strony istnieją dowody na słabą ruchliwość cytokinin. Obok dyskusyjnych morfologicznych i fizjologicznych obserwacji (np. znacznie szybsze starzenie się liści przy podstawie pędu, gdzie powinno być znacznie więcej cytokinin niż w górnej części pędu) istnieją wyniki doświadczeń ewidentnie wskazujące na słabe przemieszczanie się cytokinin. W doświadczeniach z kulturami in vitro stwierdzono, że bardzo niewielka ilość 14C-BA była przemieszczana do górnej części pędów. Prawie cała ilość pobranej BA pozostawała w podstawowej części pędu. Ograniczony transport cytokinin wykazano również w doświadczeniu z całymi roślinami [4,45,49, 52]. Przy traktowaniu roślin należy brać pod uwagę możliwość słabego przemieszczania się cytokinin.